|
元素 名称 |
铌 |
元素符号 | Nb |
相对原子质量 (12C = 12.0000) |
92.90638 |
原子 序数 |
41 |
|---|---|---|---|---|---|---|---|
| 英文名称 | Niobium | ||||||
|
原 子 结 构 |
原子半径/Å: 2.08
电子构: 1s2 2s2p6 3s2p6d10 4s2p6d4 5s1 共价半径/Å: 1.34 原子体积/cm3/mol:
10.87
离子半径/Å: 0.69 氧化态: 5,3 |
电 子 模 |
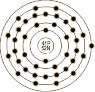 |
||||
|
发 现 |
1801年, 由 C. Hatchett (英国,伦敦)发现。 | ||||||
|
来 源 |
存在于矿物钶铁矿(columbite)中。 | ||||||
|
用 途 |
用其做成的不锈钢合金,可用于和反应器,火箭,切削工具,管道,超磁体等。 | ||||||
|
物 理 性 质 |
状态: 软的白色有光泽过渡金属。
沸 点(℃): 4744 比 热/J/gK: 0.26 熔化热/KJ/mol: 26.4 导热系数/W/cmK: 0.537 闪 点/℃: 熔 点(℃): 2468
密度(g/cc,300K): 8.57 蒸发热/KJ/mol: 682 导电率/106/cm: 0.0693 自燃点/℃: |
||||||
|
地 质 数 据 |
丰 度
太阳(相对于 H=1×1012): 79 地壳/p.p.m.: 20 太平洋表面: 大西洋深处: 滞留时间/年:
海水中/p.p.m.: 9 × 10-7 大西洋表面: 大气/p.p.m.(体积): 太平洋深处: |
||||||
|
生 物 数 据 |
人体中含量
器官中: 血/mg dm-3 : 0.005 骨/p.p.m.: < 0.07 肝/p.p.m.: 0.14
肌肉/p.p.m.: 0.14 日摄入量/mg: 0.02 - 0.6 人(70Kg)均体内总量/mg: 1.5 |
||||||
先用2分钟时间看一个不伦不类的小故事:
侵害:从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。刚嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏了一把,亲娘一生气,当时就休克了。 这下不得了,娘家要上告了。铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个仙人住的地方。 这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾牵来一只鹅 ,因为它们不喜欢冬天,所以要去南方,一路上还相互提醒:南方多雨,要注意防雷啊。
看完了吗? 现在我们把这个故事浓缩一下,再用6分钟时间,把它背下来。侵害 鲤皮捧碳 蛋养福奶 那美女桂林留绿牙 嫁给康太反革命 铁姑捏痛新嫁者 生气 休克 如此一告你 不得了 老爸银哥印西提 地点仙 (彩)色贝(壳)蓝(色)河 但(见)乌(鸦)(引)来鹅 一白巾 供它牵 必不爱冬(天) 防雷啊!
第一周期:氢 氦----侵害
第二周期:锂 铍 硼 碳 氮 氧 氟 氖----鲤皮捧碳 蛋养福奶
第三周期:钠 镁 铝 硅 磷 硫 氯 氩----那美女桂林留绿牙
第四周期:钾 钙 钪 钛 钒 铬 锰----嫁给康太反革命
铁 钴 镍 铜 锌 镓 锗----铁姑捏痛新嫁者
砷 硒 溴 氪----生气 休克
第五周期:铷 锶 钇 锆 铌 ----如此一告你
钼 锝 钌----不得了
铑 钯 银 镉 铟 锡 锑 ----老爸银哥印西提
碲 碘 氙----地点仙
第六周期:铯 钡 镧 铪----(彩)色贝(壳)蓝(色)河
钽 钨 铼 锇---- 但(见)乌(鸦)(引)来鹅
铱 铂 金 汞砣 铅 ----一白巾 供它牵
铋 钋 砹 氡----必不爱冬(天)
第七周期:钫 镭 锕----防雷啊!
1.化学元素周期表是根据核电荷数从小至大排序的化学元素列表。列表大体呈长方形,某些元素周期中留有空格,使特性相近的元素归在同一族中,如碱金属元素、碱土金属、卤族元素、稀有气体等。这使周期表中形成元素分区且分有七主族、七副族、Ⅷ族、0族。由于周期表能够准确地预测各种元素的特性及其之间的关系,因此它在化学及其他科学范畴中被广泛使用,作为分析化学行为时十分有用的框架。
2.现代化学的元素周期律是1869年俄国科学家门捷列夫(Dmitri Mendeleev)首先创造的,他将当时已知的63种元素依相对原子质量大小并以表的形式排列,把有相似化学性质的元素放在同一列,制成元素周期表的雏形。经过多年修订后才成为当代的周期表。
3.在周期表中,元素是以元素的原子序数排列,最小的排行最先。表中一横行称为一个周期,一列称为一个族。原子半径由左到右依次减小,上到下依次增大。
4.在化学教科书和字典中,都附有一张“元素周期表(英文:the periodic table of elements)”。这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。看到这张表,人们便会想到它的最早发明者——门捷列夫。1869年,俄国化学家门捷列夫按照相对原子质量由小到大排列,将化学性质相似的元素放在同一纵行,编制出第一张元素周期表。元素周期表揭示了化学元素之间的内在联系,使其构成了一个完整的体系,成为化学发展史上的重要里程碑之一。随着科学的发展,元素周期表中未知元素留下的空位先后被填满。当原子结构的奥秘被发现时,编排依据由相对原子质量改为原子的质子数﹙核外电子数或核电荷数﹚,形成现行的元素周期表。
5.按照元素在周期表中的顺序给元素编号,得到原子序数。原子序数跟元素的原子结构有如下关系:
6.质子数=原子序数=核外电子数=核电荷数
7.利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗)。
8.1913年英国科学家莫色勒利用阴极射线撞击金属产生射线X,发现原子序数越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序数)排列。后来又经过多名科学家多年的修订才形成当代的周期表。 将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵列。每一种元素都有一个序号,大小恰好等于该元素原子的核内质子数,这个序号称为原子序数。在周期表中,元素是以元素的原子序数排列,最小的排行最前。表中一横行称为一个周期,一列称为一个族。
9.原子的核外电子排布和性质有明显的规律性,科学家们是按原子序数递增排列,将电子层数相同的元素放在同一行,将最外层电子数相同的元素放在同一列。
10.元素周期表有7个周期,16个族。每一个横行叫作一个周期,每一个纵行叫作一个族(VIII族包含三个纵列)。这7个周期又可分成短周期(1、2、3)、长周期(4、5、6、7)。共有16个族,从左到右每个纵列算一族(VIII族除外)。例如:氢属于IA族元素,而氦属于0族元素。
11.元素在周期表中的位置不仅反映了元素的原子结构,也显示了元素性质的递变规律和元素之间的内在联系。使其构成了一个完整的体系,被称为化学发展的重要里程碑之一。
12.同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(0族元素除外)。失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右递增(第一周期除外,第二周期的O、F元素除外)。
13.同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子半径增大,原子序数递增,元素金属性递增,非金属性递减。
14.元素周期表的意义重大,科学家正是用此来寻找新型元素及化合物。

